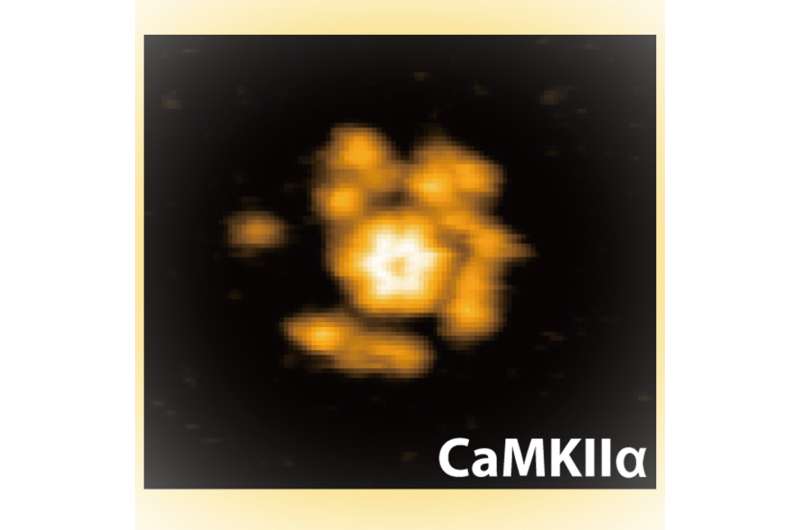
金泽大学(Kanazawa University)的研究人员在《科学进展》(Science Advances)上发表了高速原子力显微镜实验报告,显示了一种酶的结构和化学变化,这种酶被认为在调节神经连接的强度方面起着至关重要的作用。
突触连接神经元,使信号在神经网络中传递。这些连接的强度各不相同,例如,根据接收到的信号及其方式增强或减弱。这种突触的“可塑性”是学习和记忆的基础,而Ca2+/钙调素依赖性蛋白激酶II (CaMKII)已知起着关键作用。
以前的研究已经为CaMKII蛋白在这些功能中的活性机制提供了一些线索,但没有人看到这些蛋白的作用。现在,高级研究研究生大学和国家生理科学研究所的Hideji Murakoshi和金泽大学的Mikihiro Shibata及其同事首次使用高速原子力显微镜(HS-AFM)观察到这些蛋白质的结构动力学,不仅在不同的状态下,而且在三种不同的物种中。
CaMKII在很多物种中都很常见,从像老鼠这样的哺乳动物到更古老的非哺乳动物物种,比如蛔虫和水螅。特别是,蛋白质的某些结构特征保存得特别好,包括激酶结构域、抑制激酶结构域活性的调控段和枢纽结构域。此外,该蛋白具有结合位点、磷酸化位点和连接区域——然而,连接区域表现出更多的可变性,这表明它的功能和激活机制更适合不同的物种。
先前的研究表明,当Ca2+/钙调蛋白结合到调控片段时,调控片段对激酶结构域的抑制被释放。激活的激酶结构域相互磷酸化,即使在Ca2+/钙调蛋白被解离后,活性仍然存在,正如研究人员在他们的报告中所描述的那样,这被“假设为分子记忆的一种形式”。
Murakoshi, Shibata和他们的同事使用原子力显微镜研究蛋白质,原子力显微镜使用纳米级尖端感知拓扑结构,就像读取黑胶唱片的针一样,光栅扫描图像平面以建立样品结构的图片。使用HS-AFM,这些图像的收集速度足够快,可以记录下这些结构如何变化的电影。
研究人员注意到对蛋白质大小和运动的各种测量——旋转回——以及激酶结构域寡聚化(即,在有限的聚合水平上将分子连接成链)和磷酸化——磷酸化基(PO3)的添加,它可以激活激酶等酶。
他们发现激酶结构域是相当可移动的,尽管这随着Ca2+/钙调蛋白的结合而降低。研究人员解释说,这种结合将蛋白质稳定在一种叫做α螺旋的特殊螺旋结构中。他们还注意到,这种结合导致蛋白质从轮毂组装延伸3纳米,他们认为这可能是将调节片段与激酶结构域的活性位点分离的原因。然后随着磷酸化,移动性再次增加,研究人员将其归因于蛋白质失去了一些螺旋结构的顺序。
在被调查的三种物种中——大鼠、蛔虫和水螅虫——murakoshi Shibata和他们的同事发现,激酶结构域只在大鼠中寡聚。此外,在大鼠体内,这种蛋白质对磷酸酶更有弹性,磷酸酶能从蛋白质中去除磷酸基团(PO4)。
“总之,”他们报告说,“我们的发现为深入了解CaMKIIα激活的分子机制提供了基础。”
本文来自作者[新闻资讯]投稿,不代表荣微轩号立场,如若转载,请注明出处:https://blog.uyxzk.cn/keji/202508-16678.html


评论列表(4条)
我是荣微轩号的签约作者“新闻资讯”!
希望本篇文章《实验揭示了记忆与学习背后的分子机制》能对你有所帮助!
本站[荣微轩号]内容主要涵盖:国足,欧洲杯,世界杯,篮球,欧冠,亚冠,英超,足球,综合体育
本文概览:金泽大学(Kanazawa University)的研究人员在《科学进展》(Science Advances)上发表了高速原子力显微镜实验报...